



⑤萃取:使用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
(1)粗盐的成分:首要是NaCl,还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质
②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;
③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;
①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉积,原溶液中必定含有SO42-。Ba2++SO42-=BaSO4↓
②Cl-(用AgNO3溶液、稀硝酸查验)加AgNO3溶液有白色沉积生成,再加稀硝酸沉积不溶解,原溶液中必定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉积生成,则原溶液中必定含有Cl-。Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸查验)先加BaCl2溶液生成白色沉积,再加稀盐酸,沉积溶解,并生成无色无味、能使弄清石灰水变污浊的气体,则原溶液中必定含有CO32-。

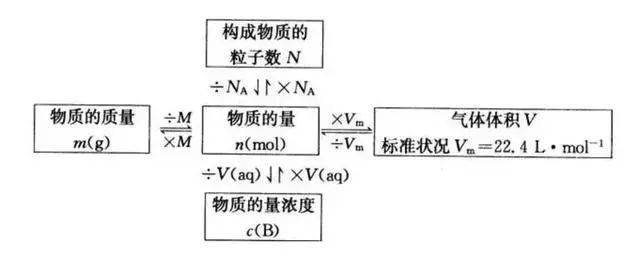
(1)涣散系组成:涣散剂和涣散质,依照涣散质和涣散剂所在的状况,涣散系能够有9种组合办法。
(2)当涣散剂为液体时,依据涣散质粒子巨细能够将涣散系分为溶液、胶体、浊液。
(1)常见胶体:Fe(OH)3胶体、Al(OH)3胶体、血液、豆浆、淀粉溶液、蛋白质溶液、有色玻璃、墨水等。
(2)胶体的特性:能产生丁达尔效应。差异胶体与其他涣散系常用办法丁达尔效应。
(3)Fe(OH)3胶体的制备办法:将饱满FeCl3溶液滴入沸水中,持续加热至系统呈红褐色,中止加热,得Fe(OH)3胶体。
非电解质:在水溶液中和熔融状况下都不能导电的化合物。(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等对错电解质。)
(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不对错电解质。
(3)能导电的物质并不满是电解质。能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
电解质需在水溶液里或熔融状况下才干导电。固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
电离方程式:要留意配平,原子个数守恒,电荷数守恒。如:Al2(SO4)3=2Al3++3SO42-
②拆:把易溶的强电解质(易容的盐、强酸、强碱)写成离子方式,这些物质拆成离子方式,其他物质一概保存化学式。
生成气体:CO32-、HCO3-等易蒸发的弱酸的酸根与H+不能许多共存。
生成H2O:①H+和OH-生成H2O。②酸式酸根离子如:HCO3-既不能和H+共存,也不能和OH-共存。如:HCO3-+H+=H2O+CO2↑, HCO3-+OH-=H2O+CO32-
①无色溶液中不存在有色离子:Cu2+、Fe3+、Fe2+、MnO4-(常见这四种有色离子)。
②留意发掘某些隐含离子:酸性溶液(或pH<7)中隐含有H+,碱性溶液(或pH>7)中隐含有OH-。
(3)判别氧化复原反响的依据:但凡有元素化合价升降或有电子的搬运的化学反响都归于氧化复原反响。
复原剂(具有复原性):失(失电子)→升(化合价升高)→氧(被氧化或产生氧化反响)→生成氧化产品。
氧化剂(具有氧化性):得(得电子)→降(化合价下降)→还(被复原或产生复原反响)→生成复原产品。
【注】必定要熟记以上内容,以便能正确判别出一个氧化复原反响中的氧化剂、复原剂、氧化产品和复原产品;氧化剂、复原剂在反响物中找;氧化产品和复原产品在生成物中找。
15、假如使元素化合价升高,即要使它被氧化,要参加氧化剂才干完成;假如使元素化合价下降,即要使它被复原,要参加复原剂才干完成。
(1)单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比火油的大。
(4)钠在空气中的改变进程:Na→Na2O→NaOH→Na2CO3→Na2CO3·10H2O(结晶)→Na2CO3(风化),终究得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na2O),跟着变成白色固体(NaOH),然后在固体外表呈现小液滴(NaOH易潮解),终究变成白色粉未(终究产品是Na2CO3)。
加热时:2Na+O2==Na2O2(钠先熔化后焚烧,宣布黄色火焰,生成淡黄色固体Na2O2。)
如钠与CuSO4溶液反响,应该先是钠与H2O反响生成NaOH与H2,再和CuSO4溶液反响,有关化学方程式:
K、Ca、Na三种单质与盐溶液反响时,先与水反响生成相应的碱,碱再和盐溶液反响
(1)单质铝的物理性质:银白色金属、密度小(属轻金属)、硬度小、熔沸点低。
常温下铝能与O2反响生成细密氧化膜,维护内层金属。加热条件下铝能与O2反响生成氧化铝:4Al+3O2==2Al2O3
23、常温下Al既能与强酸反响,又能与强碱溶液反响,均有H2生成,也能与不生动的金属盐溶液反响:
24、铝与某些金属氧化物的反响(如V、Cr、Mn、Fe的氧化物)叫做铝热反响Fe2O3+2Al == 2Fe+Al2O3,Al 和 Fe2O3的混合物叫做铝热剂。使用铝热反响焊接钢轨。
(1)单质铁的物理性质:铁片是银白色的,铁粉呈黑色,纯铁不易生锈,但生铁(含碳杂质的铁)在湿润的空气中易生锈。(原因:构成了铁碳原电池。铁锈的首要成分是Fe2O3)。
3Fe+2O2===Fe3O4(现象:剧烈焚烧,火星四射,生成黑色的固体)
(1)Al2O3的性质:氧化铝是一种白色难溶物,其熔点很高,可用来制作耐火材料如坩锅、耐火管、耐高温的试验仪器等。
(2)铁的氧化物的性质:FeO、Fe2O3都为碱性氧化物,能与强酸反响生成盐和水。
③Al(OH)3的制备:试验室用可溶性铝盐和氨水反响来制备Al(OH)3
由于强碱(如NaOH)易与Al(OH)3反响,所以试验室不必强碱制备Al(OH)3,而用氨水。
(2)铁的氢氧化物:氢氧化亚铁Fe(OH)2(白色)和氢氧化铁Fe(OH)3(红褐色)
(3)氢氧化钠NaOH:俗称烧碱、火碱、苛性钠,易潮解,有强腐蚀性,具有碱的通性。
①铁盐(铁为+3价)具有氧化性,能够被复原剂(如铁、铜等)复原成亚铁盐:2FeCl3+Fe=3FeCl2( 2Fe3++Fe=3Fe2+ )(价态归中规则)
亚铁盐(铁为+2价)具有复原性,能被氧化剂(如氯气、氧气、硝酸等)氧化成铁盐:2FeCl2+Cl2=2FeCl3 ( 2Fe2++Cl2=2Fe3++2Cl- )
c.参加NaOH溶液反响先生成白色沉积,敏捷变成灰绿色沉积,最终变成红褐色沉积。
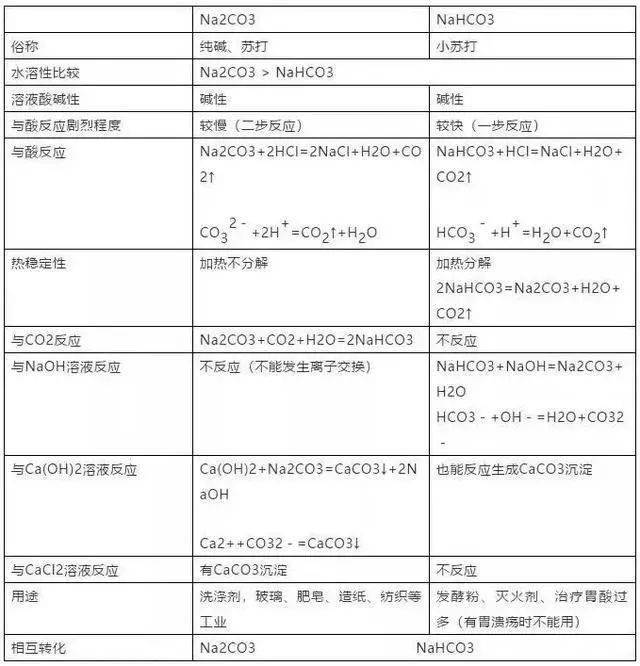
(2)操作进程:铂丝(或铁丝)用盐酸浸洗后灼烧至无色,沾取试样(单质、化合物、气、液、固均可)在火焰上灼烧,调查色彩。
(3)重要元素的焰色:钠元素黄色、 钾元素紫色(透过蓝色的钴玻璃调查,以扫除钠的焰色的搅扰)
焰色反响属物理改变。与元素存在状况(单质、化合物)、物质的集合状况(气、液、固)等无关,只要少量金属元素有焰色反响。
硅元素在地壳中的含量排第二,在自然界中没有游离态的硅,只要以化合态存在的硅,常见的是二氧化硅、硅酸盐等。
硅的原子结构暗示图为,硅元素坐落元素周期表第三周期第ⅣA族,硅原子最外层有4个电子,既不易失掉电子又不易得到电子,首要构成四价的化合物。
(1)SiO2的空间结构:立体网状结构,SiO2直接由原子构成,不存在单个SiO2分子。
(3)化学性质:SiO2常温下化学性质很不生动,不与水、酸反响(氢氟酸在外),能与强碱溶液、氢氟酸反响,高温条件下能够与碱性氧化物反响:
①与强碱反响:SiO2+2NaOH=Na2SiO3+H2O(生成的硅酸钠具有粘性,所以不能用带磨口玻璃塞试剂瓶寄存NaOH溶液和Na2SiO3溶液,避免Na2SiO3将瓶塞和试剂瓶粘住,打不开,使用橡皮塞)。
②与氢氟酸反响[SiO2的特性]:SiO2+4HF=SiF4↑+2H2O(使用此反响,氢氟酸能雕琢玻璃;氢氟酸不能用玻璃试剂瓶寄存,使用塑料瓶)。
(4)用处:光导纤维、玛瑙饰物、石英坩埚、水晶镜片、石英钟、仪器轴承、玻璃和建筑材料等。
(2)化学性质:H2SiO3是一种弱酸,酸性比碳酸还要弱,其酸酐为SiO2,但SiO2不溶于水,故不能直接由SiO2溶于水制得,而用可溶性硅酸盐与酸反响制取:(强酸制弱酸原理)
硅酸盐:硅酸盐是由硅、氧、金属元素组成的化合物的总称。硅酸盐品种许多,大多数难溶于水,最常见的可溶性硅酸盐是Na2SiO3,Na2SiO3的水溶液俗称水玻璃,又称泡花碱,是一种无色粘稠的液体,能够作黏胶剂和木材防火剂。硅酸钠水溶液久置在空气中简单蜕变:
硅酸盐由于组成很杂乱,常用氧化物的方式表明:生动金属氧化物→较生动金属氧化物→二氧化硅→水。氧化物前系数装备准则:除氧元素外,其他元素按装备前后原子个数守恒准则装备系数。
氯元素坐落元素周期表中第三周期第ⅦA族,氯原子最外电子层上有7个电子,在化学反响中很简单得到1个电子构成
Cl-,化学性质生动,在自然界中没游离态的氯,氯只以化合态存在(首要以氯化物和氯酸盐)。
(1)物理性质:黄绿色有刺激性气味有毒的气体,密度比空气大,易液化成液氯,易溶于水。(氯气搜集办法—向上排空气法或许排饱满食盐水;液氯为纯洁物)
(2)化学性质:氯气化学性质十分生动,很简单得到电子,作强氧化剂,能与金属、非金属、水以及碱反响。
(考虑:怎样制备FeCl2?Fe+2HCl=FeCl2+H2↑,铁跟盐酸反响生成FeCl2,而铁跟氯气反响生成FeCl3,这阐明Cl2的氧化性强于盐酸,是强氧化剂。)
Cl2+H2 ===点着 2HCl(氢气在氯气中焚烧现象:安静地焚烧,宣布苍白色火焰)
将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水弱小电离出来的)。
(1)强氧化性:Cl2是新制氯水的首要成分,试验室常用氯水替代氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反响。
(2)漂白、消毒性:氯水中的Cl2和HClO均有强氧化性,一般在使用其漂白和消毒时,应考虑HClO,HClO的强氧化性将有色物质氧化成无色物质,不行逆。
(3)酸性:氯水中含有HCl和HClO,故可被NaOH中和,盐酸还可与NaHCO3,CaCO3等反响。
(4)不稳定性:HClO不稳定光照易分化。,因而久置氯水(浅黄绿色)会变成稀盐酸(无色)失掉漂白性。
(5)沉积反响:参加AgNO3溶液有白色沉积生成(氯水中有Cl-)。自来水也用氯水灭菌消毒,所以用自来水制造以下溶液如KI、 KBr、FeCl2、Na2SO3、Na2CO3、NaHCO3、AgNO3、NaOH等溶液会蜕变
此反响用来制漂白粉,漂白粉的首要成分为Ca(ClO)2和CaCl2,有效成分为Ca(ClO)2。
枯燥的氯气不能使红纸褪色,由于不能生成HClO,湿的氯气能使红纸褪色,由于氯气产生下列反响Cl2+H2O=HCl+HClO。
漂白粉久置空气会失效(触及两个反响):Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
漂白粉蜕变会有CaCO3存在,外观上会结块,久置空气中的漂白粉参加浓盐酸会有CO2气体生成,含CO2和HCl杂质气体。
原理:依据Cl-与Ag+反响生成不溶于酸的AgCl沉积来查验Cl-存在。
办法:先加稀硝酸酸化溶液(扫除CO32-搅扰)再滴加AgNO3溶液,如有白色沉积生成,则阐明有Cl-存在。
硫元素最外层电子数为6个,化学性质较生动,简单得到2个电子呈-2价或许与其他非金属元素结组成呈+4价、+6价化合物。硫元素在自然界中既有游离态又有化合态。(如火山口中的硫就以单质存在)
②化学性质:S+O2 ===点着 SO2(空气中点着淡蓝色火焰,纯氧中蓝紫色)
(1)物理性质:无色、有刺激性气味有毒的气体,易溶于水,密度比空气大,易液化。
(3)化学性质:①SO2能与水反响SO2+H2OH2SO3(亚硫酸,中强酸)此反响为可逆反响。
可逆反响界说:在相同条件下,正逆方向一同进行的反响。(关键词:相同条件下)
②SO2为酸性氧化物,是亚硫酸(H2SO3)的酸酐,可与碱反响生成盐和水。
将SO2逐步通入Ca(OH)2溶液中先有白色沉积生成,后沉积消失,与CO2逐步通入Ca(OH)2溶液试验现象相同,所以不能用石灰水来辨别SO2和CO2。能使石灰水变污浊的无色无味的气体必定是二氧化碳,这说法是对的,由于SO2是有刺激性气味的气体。
③SO2具有强复原性,能与强氧化剂(如酸性高锰酸钾溶液、氯气、氧气等)反响。SO2能使酸性KMnO4溶液、新制氯水褪色,显现了SO2的强复原性(不是SO2的漂白性)。
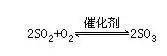
SO2+Cl2+2H2O=H2SO4+2HCl(将SO2气体和Cl2气体混合后效果于有色溶液,漂白效果将大大削弱。)
④SO2的弱氧化性:如2H2S+SO2=3S↓+2H2O(有黄色沉积生成)
⑤SO2的漂白性:SO2能使品红溶液褪色,加热会康复本来的色彩。用此能够查验SO2的存在。
(1)浓硫酸的物理性质:纯的硫酸为无色油状粘稠液体,能与水以恣意比互溶(稀释浓硫酸要标准操作:注酸入水且不断拌和)。质量分数为98%(或18.4mol/l)的硫酸为浓硫酸。不蒸发,沸点高,密度比水大。
①吸水性:浓硫酸可吸收结晶水、湿存水和气体中的水蒸气,可作枯燥剂,可枯燥H2、O2、SO2、CO2等气体,但不行拿来枯燥NH3、H2S、HBr、HI、C2H4五种气体。
②脱水性:能将有机物(蔗糖、棉花等)以水分子中H和O原子个数比2︰1脱水,炭化变黑。
③强氧化性:浓硫酸在加热条件下显现强氧化性(+6价硫表现了强氧化性),能与大多数金属反响,也能与非金属反响。
浓硫酸的强氧化性使许多金属能与它反响,但在常温下,铝和铁遇浓硫酸时,因外表被浓硫酸氧化成一层细密氧化膜,这层氧化膜阻挠了酸与内层金属的进一步反响。这种现象叫金属的钝化。铝和铁也能被浓硝酸钝化,所以,常温下能够用铁制或铝制容器盛放浓硫酸和浓硝酸。
一氧化氮:无色气体,有毒,能与人血液中的血红蛋白结合而使人中毒(与CO中毒原理相同),不溶于水。是空气中的污染物。
二氧化氮:红棕色气体(与溴蒸气色彩相同)、有刺激性气味、有毒、易液化、易溶于水,并与水反响:
3NO2+H2O=2HNO3+NO,此反响中NO2既是氧化剂又是复原剂。以上三个反响是“雷雨固氮”、“雷雨发庄稼”的反响。
(1)硝酸物理性质:纯硝酸是无色、有刺激性气味的油状液体。低沸点(83℃)、易蒸发,在空气中遇水蒸气呈白雾状。98%以上的硝酸叫“发烟硝酸”,常用浓硝酸的质量分数为69%。
(2)硝酸的化学性质:具有一般酸的通性,稀硝酸遇紫色石蕊试液变赤色,浓硝酸遇紫色石蕊试液先变红(H+效果)后褪色(浓硝酸的强氧化性)。用此试验可证明浓硝酸的氧化性比稀硝酸强。浓硝酸和稀硝酸都是强氧化剂,能氧化大多数金属,但不放出氢气,一般浓硝酸产生NO2,稀硝酸产生NO,如:
反响①复原剂与氧化剂物质的量之比为1︰2;反响②复原剂与氧化剂物质的量之比为3︰2。
常温下,Fe、Al遇浓H2SO4或浓HNO3产生钝化,(说成不反响是不当的),加热时能产生反响:
当溶液中有H+和NO3-时,相当于溶液中含HNO3,此刻,由于硝酸具有强氧化性,使得在酸性条件下NO3-与具有强复原性的离子如S2-、Fe2+、SO32-、I-、Br-(一般是这几种)因产生氧化复原反响而不能许多共存。(有沉积、气体、难电离物生成是因产生复分化反响而不能许多共存。)
(1)氨气的物理性质:无色气体,有刺激性气味、比空气轻,易液化,极易溶于水,1体积水能够溶解700体积的氨气(可做赤色喷泉试验)。浓氨水易挥宣布氨气。
氨气或液氨溶于水得氨水,氨水的密度比水小,而且氨水浓度越大密度越小,核算氨水浓度时,溶质是NH3,而不是NH3·H2O。
氨水中的微粒:H2O、NH3、NH3·H2O、NH4+、OH—、H+(极少量,水弱小电离出来)。
因NH3溶于水呈碱性,所以能用湿润的赤色石蕊试纸查验氨气的存在,因浓盐酸有蒸发性,所以也能够用蘸有浓盐酸的玻璃棒接近集气瓶口,假如有许多白烟生成,能够证明有NH3存在。
a. 湿润的赤色石蕊试纸(NH3是仅有能使湿润的赤色石蕊试纸变蓝的气体)
⑤枯燥:用碱石灰(NaOH与CaO的混合物)或生石灰在枯燥管或U型管中枯燥。不能用CaCl2、P2O5、浓硫酸作枯燥剂,由于NH3能与CaCl2反响生成CaCl2·8NH3。P2O5、浓硫酸均能与NH3反响,生成相应的盐。所以NH3一般用碱石灰枯燥。
⑥吸收:在试管口塞有一团湿的棉花其效果有两个:一是减小氨气与空气的对流,便利搜集氨气;二是吸收剩余的氨气,避免污染空气。
(4)氨气的用处:液氨易蒸发,汽化进程中会吸收热量,使得周围环境和温度下降,因而,液氨能够作制冷剂。
(2)枯燥的铵盐能与碱固体混合加热反响生成氨气,使用这个性质能够制备氨气:
(3)NH4+的查验:样品加碱混合加热,放出的气体能使湿的赤色石蕊试纸变蓝,则证明该物质会有NH4+。
等待同学们在下面进行留言打卡~ 让我看到你们的坚持!需求哪部分常识点,留言给化学姐,逐个组织~
